Предложите статью к публикации
Библиотека
Статьи и публикации
15 Декабря 2020
Эндофитные Бактерии Bacillus Subtilis 26Д снижают пораженность растений картофеля фитофторозом, стимулируя транскрипционную активность жасмонат-зависимых генов
Эндофитные Бактерии Bacillus Subtilis 26Д снижают пораженность растений картофеля фитофторозом, стимулируя транскрипционную активность жасмонат-зависимых генов
Современные интенсивные технологии сельского хозяйства требуют комплексного подхода к защите растений от повреждений патогенами и насекомыми-фитофагами. Химические средства защиты растений в основной массе являются одними из опаснейших поллютантов, кроме того, в популяциях патогенов и вредителей идет отбор наиболее резистентных к ним форм, что приводит к потере их эффективности. Экологически безопасным приемом повышения продуктивности и устойчивости растений является обработка семян микроорганизмами, способными контролировать развитие фитопатогенов и стимулировать рост растений. В настоящее время большие перспективы связаны с разработкой микробных биопрепаратов на основе эндофитных штаммов бактерий и грибов, которые населяют внутренние ткани растений без вреда для хозяина. Кроме того, эндофитность биологического агента может позволить снизить кратность обработок, как как подобный симбиоз поддерживается длительное время и выработка актвных компонентов происходит непрерывно. Особо привлекательными среди них для промышленного (коммерческого) производства являются штаммы бактерий из рода Bacillus. На основе одного из штаммов B.subtilis 26Д создан препарат Фитоспорин, эффективный против плесневения и гнилей семян различных культур, черной ножки, фитофтороза, альтернариоза картофеля и способный непосредственно воздействовать на ростовые характеристики патогенов.
Нашей задачей было протестировать способность бактерий B.subtilis 26Д влиять на поражаемость растений картофеля возбудителем фитофтороза P.infestans. В рамках этого было исследовано содержание перекиси водорода и активность пероксидаз картофеля, а так же транскрипционная активность ряда жасмонатиндуцируемых защитных генов – PR-6, алленоксидсинтазы и оксо-ФДК-редуктазы. Последние так же являются ферментами синтеза ЖК в растениях. Пробирочные стерильные растения сорта Ранняя Роза после 10 суток культивирования на среде Мурасиге-Скуга обрабатывали бактериальной суспензией штамма B. subtilis 26Д путем нанесения 5 мкл суспензии (109 клеток/мл). Через 20 суток после обработки часть растений инфицировали возбудителем фитофтороза и наблюдали развитие симптомов заболевания. Изображения инфицированных листьев анализировали в программе ImageJ, о пораженности судили по проценту поврежденной площади от общей площади листа. Визуальные симптомы болезни наблюдали в течение 10 суток, фотографии анализировали в программе ImageJ.
Тотальную РНК выделяли с помощью реактива Тризол (Molecular Research Center, Inc, США), согласно протоколу фирмы-поставщика. Синтез кДНК, на основе мРНК проводили с использованием праймеров и фермента M-MLV обратной транскриптазы по протоколу фирмыпоставщика (Fermentas, США). кДНК использовали в реакции амплификации с праймерами к генам анионной пероксидазы картофеля М21334, PR-6 (ЖКчувстивтельные гены), а также генов биосинтеза ЖК (алленоксидсинтазы (AOS) и 12-оксо-(10,15Z)- фитодиеновой кислоты - редуктазы (OPR). Анализ экспрессии генов PR-белков проводили методом количественной ПЦР в режиме реального времени на приборе “iCycler iQ5 Real-time PCR Detection System” (“Bio-Rad”, США) с использованием интеркалирующего красителя SYBR Green I (“Синтол”, Россия). Изменения в транскрипционной активности генов (оценка числа копий мРНК для каждого гена) определяли относительного референсного гена St_act c помощью программного обеспечения “iCycler iQ5 Real-Time Detection System software” (“Bio-Rad”, США).
Локализацию лигнина и пероксидазной активности в листьях изучали через 24 ч после инокуляции растений. При анализе локализации пероксидазы листья обрабатывали смесью из 0.01% 3.3 диаминобензидина (ДАБ) и 0.02% Н2О2 в 0.1 М ФБ 30 мин при вакуумной инфильтрации перед фиксацией в 96% этаноле при 4° С в течение 4 ч. Аутофлуоресценцию лигнина в листьях зараженных растений изучали с помощью лазерного сканирующего конфокального микроскопа LSM-510 на основе инвертированного микроскопа Axiovert 200M («Carl Zeiss», Германия). Для возбуждения автофлуоресценции использовали аргоновый лазер 30 мВт с длиной волны 488 нм, дихроичное зеркало 490 нм и пропускающий фильтр 505 нм.
Было выявлено, что в отсутствие обработки B.subtilis 26Д инфицирование вызывает только кратковременный подъем транскрипционной активности генов анионной пероксидазы и оксо-ФДКредуктазы на первые сутки после инфицирования. При этом активность гена алленоксидсинтазы в инфицированных растениях на 1 сутки снижена и увеличивается только на 3 сутки, чему соответствует постепенное увеличение транскрипционной активности гена PR-6 белка до 6-ти кратного на 3 сутки. При этом обработка растений суспензией бактериальных клеток в небольшой степени влияет на содержание транскриптов исследуемых генов (за исключением значительной активации транскрипции гена PR-6 белка), однако инфицирование обработанных растений вызывает продолжительное накопление транскриптов гена М21334 анионной пероксидазы. Кроме того, в данном варианте наблюдалась трехкратная активация транскрипции генов оксо-ФДК-редуктазы и алленоксидсинтазы на 1 сутки после инфицирования. При этом содержание транскриптов гена алленоксидсинтазы оставалось высоким в последующие сутки после инфицирования. Следует отметить, что в данном варианте 6-ти кратное по сравнению с контролем превышение содержания транскриптов жасмонат-чувствительного гена PR-6 достигалось уже на 1 сутки после инфицирования, что может быть обусловлено наблюдаемым увеличением активности генов ферментов синтеза ЖК в растении.
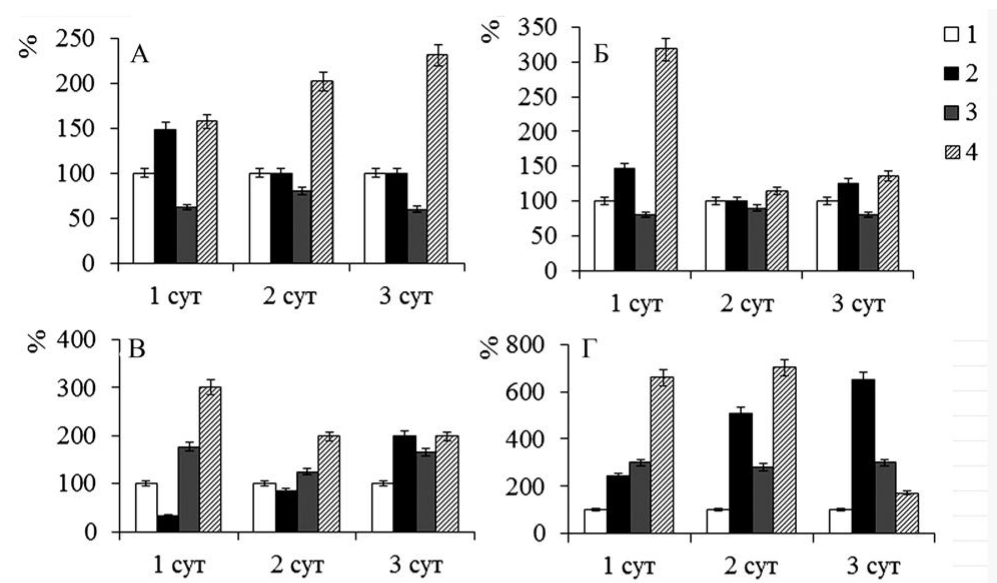
Рис. 1. Транскрипционная активность генов, кодирующих пероксидазу М21334 (А), оксо-ФДК-редуктазу (Б), алленоксидсинтазу (В) и белок PR-6 (Д) картофеля под воздействием B.subtilis 26Д в здоровых и инфицированных фитофторозом растениях картофеля. 1 – необработанный незараженный контроль; 2 – инфицирование; 3 – B.subtilis 26Д; 4 – B.subtilis 26Д + инфицирование. Транскрипционная активность генов исследовалась через 48 часов после инфицирования. Данные по транскрипционной активности генов нормализованы против актина. Figure 1. Transcriptional activity of genes encoding M21334 peroxidase (A), oxo-FDC reductase (B), allenoxyntase (C), and PR-6 protein (D) in potatoes under the influence of B.subtilis 26D in healthy and late blight-infected potato plants. 1 - untreated uninfected control; 2 - infection; 3 - B. subtilis 26D; 4 - B.subtilis 26D + infection. Transcriptional activity of the genes was studied 48 hours after infection. Data on gene transcriptional activity were normalized against actin
Ранее нами было показано, что сниженная экспрессия анионной пероксидазы М21334 в растениях приводила к недостаточной лигнификации клеточных стенок при воздействии P. infestans, и, в свою очередь, к снижению устойчивости к патогену [4]. Как видно из рис. 2, инфицирование растений картофеля приводит к лигнификации клеток, прилегающих к месту внедрения патогена и зоне развития СВЧ. Присутствие клеток эндофитных бактерий B. subtilis 26Д в тканях растений способствовало как более выраженной автофлуоресценции клеточных стенок в норме, так и интенсификации образования лигнина вокруг пораженных зон, что может объясняться увеличением пероксидазной активности в клеточных стенках как неинфицированных, так и инфицированных растений картофеля, обработанных B. subtilis 26Д (рис. 1).
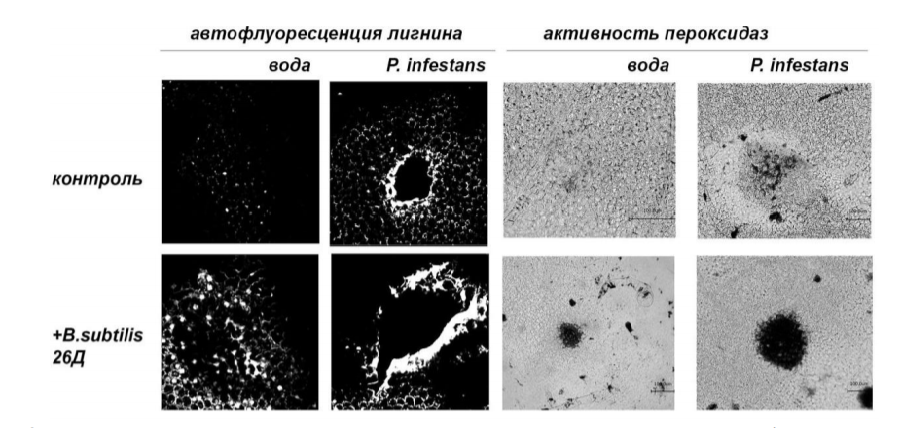
Рис. 2. Накопление лигнина и активность пероксидаз в клеточных стенках растений картофеля под действием эндофитных бактерий B.subtilis 26Д и инфицирования возбудителем фитофтороза.
B.subtilis 26Д стимулирует локальный иммунный ответ растений на внедрение патогена и способствует увеличению активности ряда защитных генов. Важно, что это приводит к заметному сокращению симптомов фитофтороза на листьях
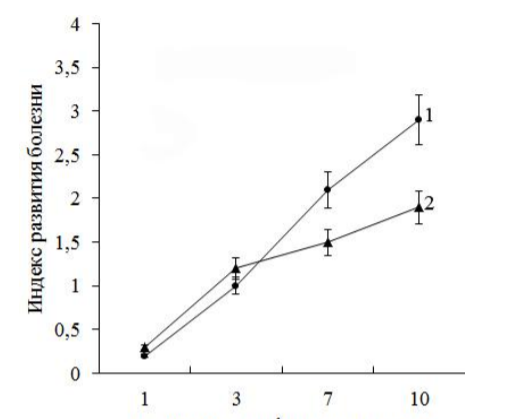 инфицированных растений (рис. 3) – в то время как площадь поражения необработанных листьев занимает около 1/3 листа, листья обработанных растений поражены менее чем на 15%. Можно предположить, что эндофитные бактерии увеличивают чувствительность растений к патогену, что позволяет в короткие сроки запустить каскад реакций, связанных с развитием защитного ответа по жасмонат-зависимому пути. Так, в первые сутки значительно увеличивается транскрипция генов ферментов синтеза ЖК, высокое содержание перекиси водорода обеспечивает восприятие ЖК-сигнала генами позднего ответа (PR-6 и М21334) и своевременно развивается устойчивость к патогену.
инфицированных растений (рис. 3) – в то время как площадь поражения необработанных листьев занимает около 1/3 листа, листья обработанных растений поражены менее чем на 15%. Можно предположить, что эндофитные бактерии увеличивают чувствительность растений к патогену, что позволяет в короткие сроки запустить каскад реакций, связанных с развитием защитного ответа по жасмонат-зависимому пути. Так, в первые сутки значительно увеличивается транскрипция генов ферментов синтеза ЖК, высокое содержание перекиси водорода обеспечивает восприятие ЖК-сигнала генами позднего ответа (PR-6 и М21334) и своевременно развивается устойчивость к патогену.Как было показано ранее, обработка суспензией B. subtilis 26Д растений устойчивого к фитофторозу сорта картофеля Невский снижала интенсивность проявления симптомов фитофтороза на листьях и приводила к увеличению содержания транскриптов ЖК-зависимого гена PR-6 . В данной работе был использован восприимчивый сорт Ранняя Роза, растения которого также становились более устойчивыми к фитофторозу после обработки бактериальными клетками.
Исследованием последних лет доказано, что многие растения, в том числе и сельскохозяйственные, содержат в своем составе микроорганизмы (бактерии, грибы), эндофитно существующие в тканях макросимбионта . Так, в настоящее время подобных эндофитов только среди бактерий обнаружено не менее 220 видов, относящихся к 71 роду . Способность эндофитов участвовать в биоконтроле фитопатогенов и насекомых, регуляции роста растений, азотфиксации, синтезе биологически активных соединений открывает значительные перспективы для последующего их использования в биотехнологии и растениеводстве. Особо интересны данные по способности эндофитов придавать растениям комплексную устойчивость как к насекомым-вредителям, так и к патогенам, наносящим ущерб сельскому хозяйству. Полученные данные убедительно доказывают, что такие микроорганизмы как штамм B.subtilis 26Д, могут быть эффективными агентами для защиты растений от патогенов и их использование является весьма перспективным.
Подписаться на новые
материалы библиотеки
материалы библиотеки
Предложить статью
к публикации
к публикации
